A transição adiabática entre dois estados em gases não é um dos isoprocessos, no entanto, desempenha um papel importante não apenas em vários processos tecnológicos, mas também na natureza. Neste artigo, consideraremos o que é esse processo e também forneceremos as equações adiabáticas para um gás ideal.
Gás ideal em resumo
Um gás ideal é aquele em que não há interações entre suas partículas e seus tamanhos são iguais a zero. Na natureza, é claro, não existem gases cem por cento ideais, pois todos eles são compostos de moléculas e átomos de tamanho, que sempre interagem entre si pelo menos com a ajuda das forças de van der Waals. No entanto, o modelo descrito é frequentemente executado com precisão suficiente para resolver problemas práticos para muitos gases reais.
A principal equação de um gás ideal é a lei de Clapeyron-Mendeleev. Está escrito da seguinte forma:
PV=nRT.
Esta equação estabelece uma proporcionalidade direta entre o produtopressão P no volume V e a quantidade de substância n na temperatura absoluta T. O valor de R é a constante do gás, que desempenha o papel de um fator de proporcionalidade.
O que é um processo adiabático?
Um processo adiabático é uma transição entre os estados de um sistema de gás no qual não há troca de energia com o ambiente. Nesse caso, todas as três características termodinâmicas do sistema (P, V, T) mudam e a quantidade de substância n permanece constante.
Distinguir entre expansão adiabática e contração. Ambos os processos ocorrem apenas devido à energia interna do sistema. Assim, como resultado da expansão, a pressão e principalmente a temperatura do sistema caem drasticamente. Por outro lado, a compressão adiabática resulta em um s alto positivo na temperatura e pressão.
Para evitar a troca de calor entre o ambiente e o sistema, este último deve ter paredes isoladas termicamente. Além disso, a redução do tempo do processo reduz significativamente o fluxo de calor de e para o sistema.
Equações de Poisson para um processo adiabático

A primeira lei da termodinâmica é escrita da seguinte forma:
Q=ΔU + A.
Em outras palavras, o calor Q comunicado ao sistema é usado para realizar trabalho A pelo sistema e para aumentar sua energia interna ΔU. Para escrever a equação adiabática, deve-se colocar Q=0, que corresponde à definição do processo em estudo. Obtemos:
ΔU=-A.
Com isocóricaprocesso em um gás ideal, todo o calor vai para aumentar a energia interna. Este fato nos permite escrever a igualdade:
ΔU=CVΔT.
Onde CV é a capacidade térmica isocórica. O trabalho A, por sua vez, é calculado da seguinte forma:
A=PdV.
Onde dV é uma pequena mudança de volume.
Além da equação de Clapeyron-Mendeleev, a seguinte equação vale para um gás ideal:
CP- CV=R.
Onde CP é a capacidade térmica isobárica, que é sempre maior que a isocórica, pois considera as perdas de gás por expansão.
Analisando as equações escritas acima e integrando sobre temperatura e volume, chegamos à seguinte equação adiabática:
TVγ-1=const.
Aqui γ é o índice adiabático. É igual à razão da capacidade de calor isobárica para isocórica. Essa igualdade é chamada de equação de Poisson para um processo adiabático. Aplicando a lei de Clapeyron-Mendeleev, você pode escrever mais duas expressões semelhantes, apenas através dos parâmetros P-T e P-V:
TPγ/(γ-1)=const;
PVγ=const.
Gráfico adiabático pode ser dado em diferentes eixos. Abaixo é mostrado em eixos P-V.
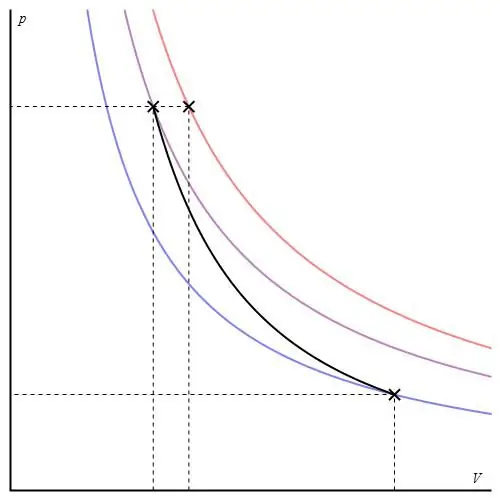
As linhas coloridas no gráfico correspondem a isotérmicas, a curva preta é um adiabat. Como pode ser visto, o adiabat se comporta de forma mais acentuada do que qualquer uma das isotérmicas. Este fato é fácil de explicar: para a isotérmica, a pressão muda de voltaproporcional ao volume, mas para a isóbata, a pressão muda mais rapidamente, pois o expoente é γ>1 para qualquer sistema de gás.
Exemplo de problema
Na natureza, em áreas montanhosas, quando a massa de ar sobe a encosta, sua pressão cai, aumenta de volume e esfria. Este processo adiabático reduz o ponto de orvalho e produz precipitação líquida e sólida.

Propõe-se resolver o seguinte problema: no processo de elevação da massa de ar ao longo da encosta da montanha, a pressão caiu 30% em relação à pressão no pé. Qual seria sua temperatura igual se no pé fosse 25 oC?
Para resolver o problema, use a seguinte equação adiabática:
TPγ/(γ-1)=const.
É melhor escrever desta forma:
T2/T1=(P2/P 1)(γ-1)/γ.
Se P1 for tomado como 1 atmosfera, então P2 será igual a 0,7 atmosferas. Para o ar, o índice adiabático é 1,4, pois pode ser considerado um gás ideal diatômico. O valor da temperatura de T1 é 298,15 K. Substituindo todos esses números na expressão acima, obtemos T2=269,26 K, que corresponde a - 3, 9 oC.






