Estudar as propriedades de um gás ideal é um tópico importante em física. A introdução às características dos sistemas gasosos começa com a consideração da equação de Boyle-Mariotte, uma vez que é a primeira lei de um gás ideal descoberta experimentalmente. Vamos considerá-lo com mais detalhes no artigo.
O que se entende por gás ideal?
Antes de falar sobre a lei de Boyle-Mariotte e a equação que a descreve, vamos definir um gás ideal. É comumente entendido como uma substância fluida na qual as partículas que a compõem não interagem entre si e seus tamanhos são desprezivelmente pequenos em comparação com as distâncias médias entre as partículas.
Na verdade, qualquer gás é real, ou seja, seus átomos e moléculas constituintes têm um determinado tamanho e não interagem entre si com a ajuda das forças de van der Waals. No entanto, em altas temperaturas absolutas (mais de 300 K) e baixas pressões (menos de uma atmosfera), a energia cinética dos átomos e moléculas é muito maior do que a energia das interações de van der Waals, de modo que o gás real no ponto indicadocondições com alta precisão podem ser consideradas ideais.
Equação Boyle-Mariotte
Propriedades dos gases Os cientistas europeus exploraram ativamente durante os séculos XVII-XIX. A primeira lei dos gases descoberta experimentalmente foi a lei que descreve os processos isotérmicos de expansão e compressão de um sistema de gás. Experimentos correspondentes foram realizados por Robert Boyle em 1662 e Edm Mariotte em 1676. Cada um desses cientistas mostrou independentemente que durante um processo isotérmico em um sistema de gás fechado, a pressão muda inversamente com o volume. A expressão matemática do processo obtida experimentalmente é escrita na seguinte forma:
PV=k
Onde P e V são a pressão no sistema e seu volume, k é alguma constante, cujo valor depende da quantidade de substância gasosa e sua temperatura. Se você construir a dependência da função P(V) em um gráfico, então será uma hipérbole. Um exemplo dessas curvas é mostrado abaixo.
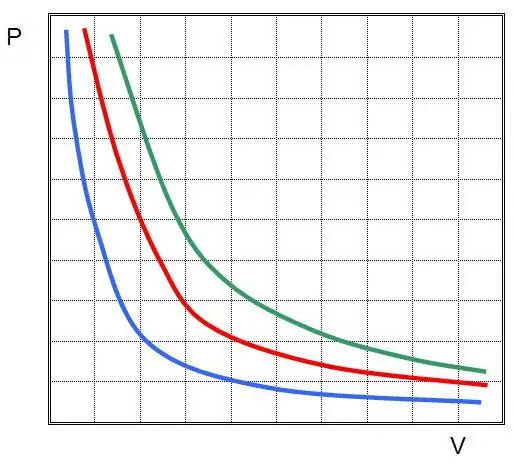
A igualdade escrita é chamada de equação de Boyle-Mariotte (lei). Esta lei pode ser brevemente formulada da seguinte forma: a expansão de um gás ideal a uma temperatura constante leva a uma diminuição proporcional da pressão nele, pelo contrário, a compressão isotérmica de um sistema de gás é acompanhada por um aumento proporcional da pressão nele.
A equação do gás ideal
A lei de Boyle-Mariotte é um caso especial de uma lei mais geral que leva os nomes de Mendeleev eClapeyron. Emile Clapeyron, resumindo as informações experimentais sobre o comportamento dos gases sob várias condições externas, em 1834 obteve a seguinte equação:
PV=nRT
Em outras palavras, o produto do volume V de um sistema de gás e a pressão P nele é diretamente proporcional ao produto da temperatura absoluta T pela quantidade de substância n. O coeficiente dessa proporcionalidade é denotado pela letra R e é chamado de constante universal do gás. Na equação escrita, o valor de R apareceu devido à substituição de uma série de constantes, que foi feita por Dmitry Ivanovich Mendeleev em 1874.
Da equação de estado universal é fácil ver que a constância da temperatura e a quantidade de substância garantem a invariância do lado direito da equação, o que significa que o lado esquerdo da equação também permanecerá constante. Neste caso, obtemos a equação de Boyle-Mariotte.

Outras leis dos gases
A equação de Clapeyron-Mendeleev escrita no parágrafo acima contém três parâmetros termodinâmicos: P, V e T. Se cada um deles é fixo e os outros dois podem mudar, então obtemos o Boyle-Mariotte, Equações de Charles e Gay-Lussac. A lei de Charles fala de uma proporcionalidade direta entre volume e temperatura para um processo isobárico, e a lei de Gay-Lussac afirma que no caso de uma transição isocórica, a pressão do gás aumenta ou diminui em proporção direta à temperatura absoluta. As equações correspondentes ficam assim:
V/T=const quando P=const;
P/T=const quando V=const.
EntãoAssim, a lei de Boyle-Mariotte é uma das três principais leis dos gases. No entanto, difere do resto em termos de dependência gráfica: as funções V(T) e P(T) são linhas retas, a função P(V) é uma hipérbole.
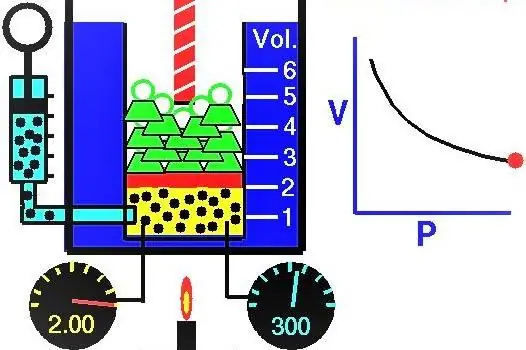
Exemplo de uma tarefa para aplicação da lei Boyle-Mariotte
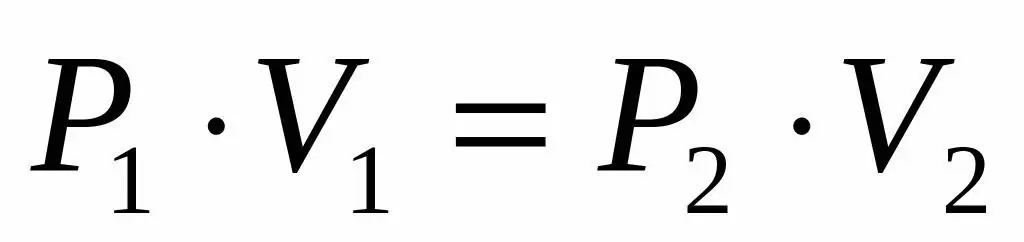
O volume de gás no cilindro sob o pistão na posição inicial era de 2 litros e sua pressão era de 1 atmosfera. Qual foi a pressão do gás depois que o pistão subiu e o volume do sistema de gás aumentou 0,5 litros. O processo é considerado isotérmico.
Como temos a pressão e o volume de um gás ideal, e também sabemos que a temperatura permanece in alterada durante sua expansão, podemos usar a equação de Boyle-Mariotte da seguinte forma:
P1V1=P2V 2
Esta igualdade diz que o produto volume-pressão é constante para cada estado do gás a uma dada temperatura. Expressando o valor P2 da igualdade, obtemos a fórmula final:
P2=P1V1/V 2
Ao fazer cálculos de pressão, você pode usar unidades fora do sistema neste caso, porque os litros vão encolher, e obtemos a pressão P2em atmosferas. Substituindo os dados da condição, chegamos à resposta para a questão do problema: P2=0,8 atmosferas.






