Os fenômenos e processos naturais ao nosso redor são bastante complexos. Para sua descrição física exata, um aparato matemático complicado deve ser usado e um grande número de fatores significativos deve ser levado em consideração. Para evitar esse problema, alguns modelos simplificados são utilizados na física, o que facilita muito a análise matemática do processo, mas praticamente não afeta a precisão de sua descrição. Um deles é o modelo de gás ideal. Vamos considerá-lo com mais detalhes no artigo.
O conceito de um gás ideal
Um gás ideal é um estado de agregação de uma substância, que consiste em pontos materiais que não interagem entre si. Vamos explicar essa definição com mais detalhes.
Primeiro, estamos falando de pontos materiais como objetos que compõem um gás ideal. Isso significa que suas moléculas e átomos não têm um tamanho, mas uma certa massa. É ousadouma aproximação pode ser feita levando em conta o fato de que em todos os gases reais a baixas pressões e altas temperaturas, a distância entre as moléculas é muito maior que suas dimensões lineares.
Em segundo lugar, as moléculas de um gás ideal não devem interagir umas com as outras. Na realidade, tais interações sempre existem. Assim, até mesmo átomos de gases nobres experimentam atração dipolo-dipolo. Em outras palavras, as interações de van der Waals estão presentes. No entanto, em comparação com a energia cinética de rotação e movimento translacional das moléculas, essas interações são tão pequenas que não afetam as propriedades dos gases. Portanto, eles não podem ser considerados na resolução de problemas práticos.
É importante notar que nem todos os gases em que a densidade é baixa e a temperatura é alta podem ser considerados ideais. Além das interações de van der Waals, existem outros tipos de ligações mais fortes, por exemplo, ligações de hidrogênio entre moléculas de H2O, que levam a uma violação grosseira das condições de idealidade do gás. Por esta razão, o vapor de água não é um gás ideal, mas o ar é.
Modelo físico de um gás ideal
Este modelo pode ser representado da seguinte forma: suponha que o sistema de gás contenha N partículas. Estes podem ser átomos e moléculas de vários produtos químicos e elementos. O número de N partículas é grande, então a unidade "mole" é geralmente usada para descrevê-lo (1 mol corresponde ao número de Avogadro). Todos eles se movem em algum volume V. Movimentos de partículassão caóticas e independentes umas das outras. Cada um deles tem uma certa velocidade v e se move ao longo de uma trajetória reta.
Teoricamente, a probabilidade de colisão entre as partículas é quase zero, pois seu tamanho é pequeno comparado às distâncias entre as partículas. No entanto, se tal colisão ocorrer, então ela é absolutamente elástica. Neste último caso, o momento total das partículas e sua energia cinética são conservados.
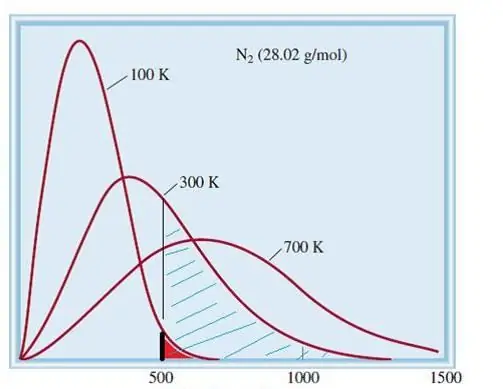
O modelo considerado de gases ideais é um sistema clássico com um grande número de elementos. Portanto, a velocidade e a energia das partículas nele obedecem à distribuição estatística de Maxwell-Boltzmann. Algumas partículas têm baixas velocidades, enquanto outras têm altas velocidades. Nesse caso, há um certo limite de velocidade estreito, no qual estão os valores mais prováveis dessa quantidade. A distribuição de velocidade das moléculas de nitrogênio é mostrada esquematicamente abaixo.
Teoria cinética dos gases
O modelo de gases ideais descrito acima determina exclusivamente as propriedades dos gases. Este modelo foi proposto pela primeira vez por Daniel Bernoulli em 1738.

Depois, foi desenvolvido até o estado atual por August Kroenig, Rudolf Clausius, Mikhail Lomonosov, James Maxwell, Ludwig Boltzmann, Marian Smoluchowski e outros cientistas.
A teoria cinética das substâncias fluidas, com base na qual o modelo de gás ideal é construído, explica duas importantes propriedades macroscópicas do sistema com base em seu comportamento microscópico:
- A pressão nos gases é o resultado da colisão das partículas com as paredes do recipiente.
- A temperatura no sistema é o resultado da manifestação do movimento constante de moléculas e átomos.
Vamos expandir as duas conclusões da teoria cinética.
Pressão do gás
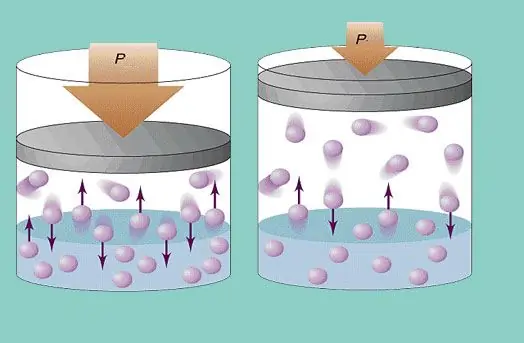
O modelo de gás ideal assume um movimento caótico constante de partículas no sistema e sua constante colisão com as paredes do vaso. Cada colisão é considerada absolutamente elástica. A massa da partícula é pequena (≈10-27-10-25 kg). Portanto, não pode criar muita pressão em uma colisão. No entanto, o número de partículas e, portanto, o número de colisões, é enorme (≈1023). Além disso, a velocidade quadrática média dos elementos é de várias centenas de metros por segundo à temperatura ambiente. Tudo isso leva à criação de uma pressão apreciável nas paredes do vaso. Pode ser calculado usando a seguinte fórmula:
P=Nmvcp2 / (3V), onde vcp é a velocidade média quadrática, m é a massa da partícula.
Temperatura absoluta
De acordo com o modelo de gás ideal, a temperatura é determinada unicamente pela energia cinética média de uma molécula ou átomo no sistema em estudo. Você pode escrever a seguinte expressão que relaciona energia cinética e temperatura absoluta para um gás ideal:
mvcp2 / 2=3/2kB T.
Aqui kB é a constante de Boltzmann. Desta igualdade obtemos:
T=mvcp2 / (3kB).
Equação de estado universal
Se combinarmos as expressões acima para pressão absoluta P e temperatura absoluta T, podemos escrever a seguinte igualdade:
PV=nRT.
Aqui n é a quantidade de substância em mols, R é a constante do gás introduzida por D. I. Mendeleev. Esta expressão é a equação mais importante na teoria dos gases ideais, pois combina três parâmetros termodinâmicos (V, P, T) e não depende das características químicas do sistema gasoso.

A equação universal foi inicialmente derivada experimentalmente pelo físico francês Emile Clapeyron no século 19 e depois trazida à sua forma moderna pelo químico russo Mendeleev, razão pela qual atualmente leva os nomes desses cientistas.






