No nosso tempo, a física tornou-se uma ciência muito comum. Está literalmente presente em todos os lugares. O exemplo mais elementar: uma macieira cresce no seu quintal e os frutos amadurecem, chega a hora e as maçãs começam a cair, mas em que direção elas caem? Graças à lei da gravitação universal, nosso feto cai no chão, ou seja, desce, mas não sobe. Foi um dos exemplos mais famosos da física, mas prestemos atenção à termodinâmica, ou mais precisamente, aos equilíbrios de fases, que não são menos importantes em nossa vida.
Termodinâmica

Primeiro de tudo, vamos olhar para este termo. ΘερΜοδυναΜική - é assim que a palavra parece em grego. A primeira parte ΘερΜo significa "calor", e a segunda δυναΜική significa "força". A termodinâmica é um ramo da física que estuda as propriedades de um sistema macroscópico, bem como várias formas de conversão e transferência de energia. Nesta seção, vários estados e processos são especialmente estudados para que o conceito de temperatura possa ser introduzido na descrição (esta é uma grandeza física que caracteriza um sistema termodinâmico e é medida usandodeterminados aparelhos). Todos os processos em andamento em sistemas termodinâmicos são descritos apenas por grandezas microscópicas (pressão e temperatura, bem como a concentração dos componentes).
Equação de Clapeyron-Clausius
Todo físico conhece essa equação, mas vamos decompô-la por partes. Refere-se aos processos de equilíbrio da transição de certa matéria de uma fase para outra. Isso é visto claramente em alguns exemplos: fusão, evaporação, sublimação (uma das formas de preservação dos produtos, que ocorre pela remoção completa da umidade). A fórmula mostra claramente os processos em andamento:
- n=PV/RT;
- onde T é a temperatura da substância;
- P-pressão;
- calor específico de R de transição de fase;
- V-mudança no volume específico.
A história da criação da equação

A equação de Clausius-Clapeyron é uma excelente explicação matemática da segunda lei da termodinâmica. Também conhecida como a "desigualdade de Clausius". Naturalmente, o teorema foi desenvolvido pelo próprio cientista, que queria explicar a relação entre o fluxo de calor no sistema e a entropia, bem como seu ambiente. Esta equação foi desenvolvida por Clausius em suas tentativas de explicar e quantificar a entropia. No sentido literal, o teorema nos dá a oportunidade de determinar se um processo cíclico é reversível ou irreversível. Essa desigualdade nos oferece uma fórmula quantitativa para entender a segunda lei.
O cientista foi um dos primeiros a trabalhar a ideia de entropia, e até deunome do processo. O que hoje é conhecido como teorema de Clausius foi publicado pela primeira vez em 1862 no sexto trabalho de Rudolf, On the Use of the Transformation Equivalence Theorem for Interior Work. O cientista tentou mostrar uma relação proporcional entre entropia e fluxo de energia por aquecimento (δ Q) no sistema. Na construção, essa energia térmica pode ser convertida em trabalho e pode ser transformada em calor através de um processo cíclico. Rudolph provou que "a soma algébrica de todas as transformações que ocorrem em um processo cíclico só pode ser menor que zero ou, em casos extremos, igual a zero."
Sistema isolado fechado
Sistema isolado é um dos seguintes:
- O sistema físico está longe de outros que não interagem com ele.
- O sistema termodinâmico é fechado por paredes rígidas e imóveis através das quais nem matéria nem energia podem passar.
Apesar de o sujeito estar relacionado internamente à sua própria gravidade, um sistema isolado é normalmente levado além dos limites da gravitação externa e outras forças distantes.
Isso pode ser contrastado com o que (na terminologia mais geral usada em termodinâmica) é chamado de sistema fechado cercado por paredes seletivas através das quais a energia pode ser transferida na forma de calor ou trabalho, mas não de matéria. E com um sistema aberto no qual a matéria e a energia entram ou saem, embora possam ter várias paredes impenetráveispartes de suas bordas.
Um sistema isolado obedece à lei de conservação. Na maioria das vezes, na termodinâmica, matéria e energia são consideradas conceitos separados.
Transições termodinâmicas
Para entender as transições de fase quânticas, é útil compará-las com as transformações clássicas (também chamadas de inversões térmicas). CPT descreve a cúspide nas propriedades termodinâmicas de um sistema. Sinaliza a reorganização das partículas. Um exemplo típico é a transição de congelamento da água, que descreve uma transição suave entre um líquido e um sólido. Os crescimentos de fase clássicos são devidos à competição entre a energia do sistema e a entropia de suas flutuações térmicas.
Um sistema clássico não tem entropia à temperatura zero e, portanto, nenhuma transformação de fase pode ocorrer. Sua ordem é determinada pelo primeiro potencial termodinâmico derivado descontínuo. E, claro, tem a primeira ordem. As transformações de fase de um ferroímã para um paraímã são contínuas e de segunda ordem. Essas mudanças constantes de uma fase ordenada para uma fase desordenada são descritas por um parâmetro de ordem que é zero. Para a transformação ferromagnética acima, o parâmetro de ordem será a magnetização total do sistema.
Potencial de Gibbs
A Energia Livre de Gibbs é a quantidade máxima de trabalho sem expansão que pode ser removida de um sistema termodinâmico fechado (que pode trocar calor e trabalhar com o meio ambiente). Talo resultado máximo só pode ser obtido em um processo completamente reversível. Quando o sistema volta do primeiro estado para o segundo, a redução da energia livre de Gibbs é igual àquela realizada pelo sistema em seu ambiente, menos o trabalho das forças de pressão.
Estados de equilíbrio

Equilíbrio termodinâmico e mecânico é um conceito axiomático da termodinâmica. Este é o estado interno de um ou mais sistemas que estão conectados por paredes mais ou menos permeáveis ou impermeáveis. Nesse estado, não há fluxos macroscópicos puros de matéria ou energia, seja dentro de um sistema ou entre sistemas.
Em sua própria concepção do estado de equilíbrio interno, a mudança macroscópica não ocorre. Os sistemas estão simultaneamente em equilíbrio térmico, mecânico, químico (constante) mútuo e de radiação. Eles podem estar na mesma forma. Nesse processo, todas as visualizações são salvas de uma só vez e indefinidamente até que a operação física seja interrompida. No equilíbrio macroscópico, ocorrem trocas equilibradas perfeitamente precisas. A prova acima é uma explicação física deste conceito.
Básico
Cada lei, teorema, fórmula tem seus próprios fundamentos. Vejamos os 3 fundamentos da lei do equilíbrio de fases.
- Fase é uma forma de matéria, homogênea em composição química, estado físico e equilíbrio mecânico. As fases típicas são sólida, líquida e gasosa. Dois líquidos imiscíveis (ou misturas de líquidos com composições diferentes) separados por uma fronteira separada são considerados duas fases distintas e sólidos imiscíveis.
- O número de componentes (C) é o número de componentes quimicamente independentes do sistema. O número mínimo de espécies independentes necessárias para determinar a composição de todas as fases do sistema.
- O número de graus de liberdade (F) neste contexto é o número de variáveis intensivas que são independentes umas das outras.
Classificação por equilíbrio de fases
- Reações de transferência líquida contínua (muitas vezes chamadas de reações de estado sólido) ocorrem entre matéria sólida de composição diferente. Eles podem incluir elementos encontrados em líquidos (H, C), mas esses elementos são retidos em fases sólidas, então nenhuma fase líquida está envolvida como reagente ou produto (H2O, CO2). As reações de transferência puras sólidas podem ser contínuas ou descontínuas, ou terminais.
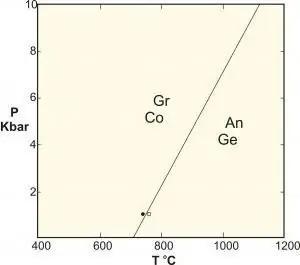
- Polimórficos são um tipo especial de reação em fase sólida que inclui fases de composição idêntica. Exemplos clássicos são as reações entre silicatos de alumínio cianita-silimanita-andalusita, a conversão de grafite em diamante a alta pressão e o equilíbrio do carbonato de cálcio.
Leis do equilíbrio

A Regra da Fábrica de Gibbs foi proposta por Josiah Willard Gibbs em seu famoso artigo intitulado "O Equilíbrio de Substâncias Heterogêneas", que apareceu de 1875 a 1878. Aplica-se asistemas heterogêneos multicomponentes não reativos em equilíbrio termodinâmico e é uma dada igualdade:
- F=C-P+2;
- onde F é o número de graus de liberdade;
- C - número de componentes;
- P - número de fases em equilíbrio termodinâmico entre si.
O número de graus de liberdade é o número de variáveis intensivas desocupadas. O maior número de parâmetros termodinâmicos, como temperatura ou pressão, que podem variar simultânea e arbitrariamente sem afetar uns aos outros. Um exemplo de sistema de um componente é aquele com um único produto químico puro, enquanto sistemas de dois componentes, como misturas de água e etanol, têm dois componentes independentes. As transições de fase típicas (equilíbrio de fase) são sólidos, líquidos, gases.
Regra de fase a pressão constante
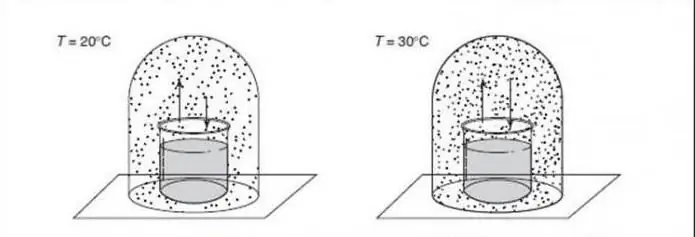
Para aplicações em ciência de materiais que lidam com mudanças de fase entre diferentes estruturas sólidas, uma pressão constante geralmente ocorre (por exemplo, uma atmosfera) e é ignorada como um grau de liberdade, então a regra se torna: F=C - P + 1.
Esta fórmula é por vezes introduzida sob o nome de "regra da fase condensada", mas como sabemos, não é aplicável a estes sistemas sujeitos a altas pressões (por exemplo, em geologia), uma vez que as consequências destas pressões podem causar consequências catastróficas.
Pode parecer que o equilíbrio de fases é apenas uma frase vazia, e existem poucos processos físicos em que este momentoestá envolvido, mas, como vimos, sem ele, muitas das leis que conhecemos não funcionam, então você precisa se familiarizar um pouco com essas regras únicas, coloridas, embora um pouco chatas. Este conhecimento tem ajudado muitas pessoas. Eles aprenderam como aplicá-los a si mesmos, por exemplo, eletricistas, conhecendo as regras para trabalhar com fases, podem se proteger de perigos desnecessários.






