Na termodinâmica, ao estudar as transições do estado inicial para o estado final de um sistema, é importante conhecer o efeito térmico do processo. O conceito de capacidade calorífica está intimamente relacionado a esse efeito. Neste artigo, consideraremos a questão do que se entende por capacidade térmica isocórica de um gás.
Gás Ideal
Um gás ideal é um gás cujas partículas são consideradas pontos materiais, ou seja, não têm dimensões, mas têm massa, e no qual toda a energia interna consiste unicamente na energia cinética do movimento das moléculas e átomos.
Qualquer gás real idealmente nunca satisfará o modelo descrito, pois suas partículas ainda têm algumas dimensões lineares e interagem entre si usando ligações fracas de van der Waals ou ligações químicas de outro tipo. No entanto, em baixas pressões e altas temperaturas, as distâncias entre as moléculas são grandes e sua energia cinética excede a energia potencial em dezenas de vezes. Tudo isso permite aplicar com alto grau de precisão o modelo ideal para gases reais.
Energia interna do gás
A energia interna de qualquer sistema é uma característica física, que é igual à soma da energia potencial e cinética. Como a energia potencial pode ser desprezada em gases ideais, podemos escrever a igualdade para eles:
U=Ek.
Onde Ek é a energia do sistema cinético. Usando a teoria da cinética molecular e aplicando a equação de estado universal de Clapeyron-Mendeleev, não é difícil obter uma expressão para U. Ela está escrita abaixo:
U=z/2nRT.
Aqui T, R e n são a temperatura absoluta, a constante do gás e a quantidade de substância, respectivamente. O valor z é um número inteiro que indica o número de graus de liberdade que uma molécula de gás tem.
Capacidade térmica isobárica e isocórica
Em física, a capacidade calorífica é a quantidade de calor que deve ser fornecida ao sistema em estudo para aquecê-lo em um kelvin. A definição inversa também é verdadeira, ou seja, a capacidade calorífica é a quantidade de calor que o sistema libera quando resfriado por um kelvin.
A maneira mais fácil para um sistema é determinar a capacidade térmica isocórica. Entende-se como a capacidade calorífica a volume constante. Como o sistema não realiza trabalho nessas condições, toda a energia é gasta no aumento das reservas internas de energia. Vamos denotar a capacidade térmica isocórica pelo símbolo CV, então podemos escrever:
dU=CVdT.
Ou seja, a variação da energia internasistema é diretamente proporcional à variação de sua temperatura. Se compararmos esta expressão com a igualdade escrita no parágrafo anterior, chegaremos à fórmula para CV em um gás ideal:
СV=z/2nR.
Esse valor é inconveniente de usar na prática, pois depende da quantidade de substância no sistema. Portanto, foi introduzido o conceito de capacidade térmica isocórica específica, ou seja, um valor que é calculado por 1 mol de gás ou por 1 kg. Vamos denotar o primeiro valor pelo símbolo CV, o segundo - pelo símbolo CV m. Para eles, você pode escrever as seguintes fórmulas:
CV=z/2R;
CVm=z/2R/M.
Aqui M é a massa molar.
Isobárica é a capacidade calorífica mantendo uma pressão constante no sistema. Um exemplo de tal processo é a expansão do gás em um cilindro sob um pistão quando aquecido. Ao contrário do processo isocórico, durante o processo isobárico, o calor fornecido ao sistema é gasto para aumentar a energia interna e realizar trabalho mecânico, ou seja:
H=dU + PdV.
A entalpia de um processo isobárico é o produto da capacidade térmica isobárica e a variação de temperatura no sistema, ou seja:
H=CPdT.
Se considerarmos a expansão a uma pressão constante de 1 mol de gás, então a primeira lei da termodinâmica será escrita como:
CPdT=CV dT + RdT.
O último termo é obtido da equaçãoClapeyron-Mendeleev. Desta igualdade segue a relação entre as capacidades térmicas isobáricas e isocóricas:
CP=CV + R.
Para um gás ideal, a capacidade calorífica molar específica a pressão constante é sempre maior que a característica isocórica correspondente por R=8, 314 J/(molK).
Graus de liberdade das moléculas e capacidade calorífica
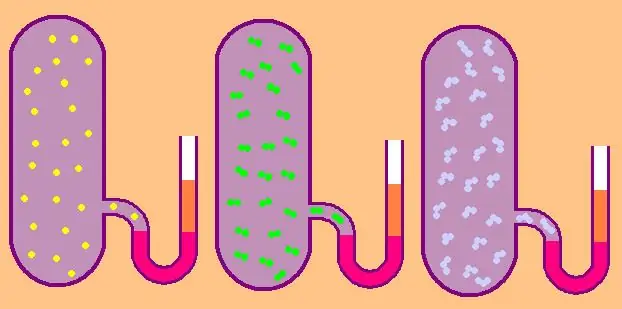
Vamos escrever novamente a fórmula para a capacidade térmica isocórica molar específica:
CV=z/2R.
No caso de um gás monoatômico, o valor z=3, pois os átomos no espaço só podem se mover em três direções independentes.
Se estamos falando de um gás constituído por moléculas diatômicas, por exemplo, oxigênio O2 ou hidrogênio H2, então, além do movimento de translação, essas moléculas ainda podem girar em torno de dois eixos perpendiculares entre si, ou seja, z será igual a 5.
Para moléculas mais complexas, use z=6. para determinar CV






